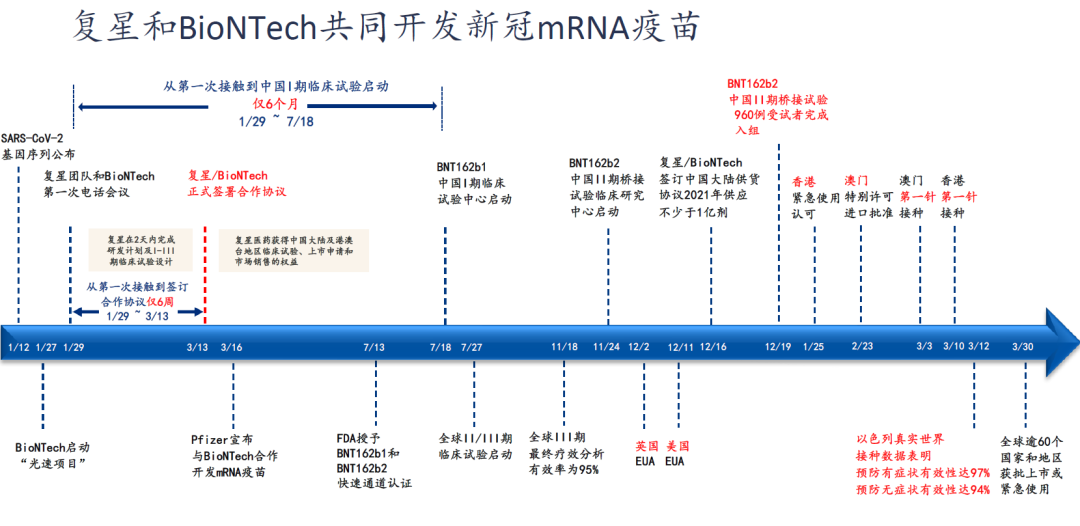
复必泰,是复星医药、biontech、辉瑞三家联合研发、数据共享

2020年3月13日,复星医药产业与BioNTech签订协议,前者由此获得了在中国独家开发、商业化基于后者专有的mRNA技术平台研发的mRNA新冠疫苗的许可;
2020年11月16日,复星医药产业mRNA新冠疫苗BNT162b2的临床试验获得中国药品监督管理局批准;
截至2020年12月19日,新冠疫苗BNT162b2在中国的II期临床试验已提前完成960位受试者入组;
2021年1月25日,“复必泰”获得香港紧急使用认可;
2021年2月23日,“复必泰”获得澳门特别许可进口批准;
2021年3月3日,澳门第一针接种;
2021年3月10日,香港第一针接种;
…
版权声明:所有瑞恩资本Ryanben Capital的原创文章,转载须联系授权,并在文首/文末注明来源、作者、微信ID,否则瑞恩将向其追究法律责任。部分文章推送时未能与原作者或公众号平台取得联系。若涉及版权问题,敬请原作者联系我们。
复星BioNTech疫苗接种注意什么?复星详解「复必泰」副作用、接种注意事项
复星医药子公司Gland Pharma在印度IPO上市,第一家中资控股的印度上市公司
香港IPO市场(前四个月):上市35家、退市21家,募资1,551亿、增7.5倍
香港 IPO中介机构排行榜 (过去24个月:2019年5月-2021年4月)



